Sách kỹ sư/Nguyên tử hóa chất/Mô hình nguyên tử
Mô hình cấu trúc nguyên tử
Mô hình Rutherford
[sửa]Ernest Rutherford (1871 - 1937) đã dùng một chùm hạt alpha bắn phá một lá vàng mỏng trong thí nghiệm mang tên ông. Hạt alpha là hạt nhân nguyên tử heli, mang điện tích dương (+2), có khối lượng khoảng bốn lần khối lượng nguyên tố hydro. Kết quả thu được cho thấy hầu hết các hạt alpha đi qua lá vàng mà không bị lệch hướng, một số hạt (1/8000 so với số hạt đi thẳng) bị lệch hướng và một số ít hạt bị bật ngược trở lại.
Kết quả này cho phép kết luận rằng nguyên tử có cấu tạo rỗng, các điện tử âm bao quanh một hạt có kích thước rất nhỏ so với kích thước nguyên tố. Trên lá kim loại các phân tử mang điện tích dương phân bố rất thưa thớt vì thế các hạt alpha đi qua lá kim loại dễ dàng. Một số hạt đi gần với các hạt điện tích dương và các hạt này tích điện lớn nên đẩy hạt alpha đi lệch hướng ban đầu hoặc ngược hướng ban đầu. Ông gọi đó là hạt nhân. Hạt nhân có các điện tử quay xung quanh giống như các hành tinh quay xung quanh Mặt Trời, tuy thể tích hạt nhân rất nhỏ so với nguyên tố nhưng phần lớn khối lượng nguyên tố lại tập trung ở trong hạt nhân. Mô hình này còn có cái tên là mẫu hành tinh nguyên tử.
Phân bố điện tử trong nguyên tử điện
[sửa]
Vào năm, Rutherford công bố mô hình nguyên tử được gọi là Mô hình nguyên tử Rutherford
- Mọi vật được tạo ra từ Nguyên tố hóa chất , phần tử nhỏ nhứt còn giử tính chất của vật
- Mọi Nguyên tố vật chất được tạo từ các phần tử điện nhỏ nhứt không thể phân chia gọi là Nguyên tử điện
- Mọi Nguyên tử điện đều có các vòng tròn Quỷ đạo chứa Điện tử âm quay quanh một Hạt nhân ở trong tâm chứa các Điện tử dương và Điện tử trung hòa
- Số nguyên tố cho biết số lượng điện tủ âm trên các Quỷ đạo và số lượng điện tủ dương trong Hạt nhân
- Ở trạng thái cân bằng, tổng điện của nguyên tử bằng không
- Chỉ có điện tử âm trên quỷ đạo ngoài cùng mới có thể tham gia các phản ứng điện
Điện tử
[sửa]Điện tử là các hạt cơ bản cấu tạo nên nguyên tử và không thể phân chia nhỏ hơn được nữa. Có tất cả ba loại hạt cơ bản đả được tìm thấy đó là Điện tử âm, Điện tử dương và Điện tử trung hòa có các tính chất sau
Điện tử Ký hiệu Dấu điện tích Khối lượng Điện tử âm Điện tử dương Điện tử trung hòa
Nhược điểm của Mô hình Rutherford đó là không thể giải thích được tại sao điện tử lại có thể ổn định trong nguyên tử mà không bị rơi vào hạt nhân.
Mô hình nguyên tử Bohr
[sửa]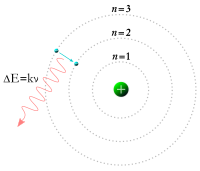
Mô hình Rutherford không thể giải thích được tại sao điện tử lại có thể ổn định trong nguyên tử mà không bị rơi vào hạt nhân. Để giải thích hiện tượng này, năm 1913, nhà vật lý lý thuyết người Đan Mạch Niels Bohr (1885 - 1962) đưa ra Mô hình nguyên tử Bohr.
Các mức năng lượng nghỉ giống như các bậc thang, điện tử không thể ở giữa các mức đó được mà chỉ có thể ở trên một bậc thang nào đó. Khi chuyển từ mức năng lượng này sang mức năng lượng khác, điện tử có thể hấp thụ hoặc phát ra năng lượng. Năng lượng hấp thụ và phát xạ của một quang tử chính bằng sự sai khác năng lượng giữa các quỹ đạo.
Tầng năng lượng lượng tử
[sửa]Năng lượng ở mức năng lượng ổn định hay ở trạng thái ổn định. Nếu nguyên tử hấp thụ năng lượng của một lực (điện, ánh sáng, ...) năng lượng của nguyên tử sẻ thay đổi lúc này điện tử nằm ở trạng thái kích thích.
- Các điện tử chuyển động xung quanh hạt nhân theo các quỹ đạo có năng lượng và bán kính cố định.
- Năng lượng của điện tử phụ thuộc vào bán kính quỹ đạo của điện tử
- Điện tử nằm trên quỹ đạo có bán kính lớn nhất sẽ có năng lượng nghỉ nhỏ nhất và năng lượng động cao nhứt
- Năng lượng ở mức năng lượng ổn định hay ở trạng thái ổn định .
- Nếu Nguyên tử hấp thụ năng lượng của một Lực (Điện , Ánh sáng ...) năng lượng của Nguyên tử sẻ thay đổi lúc này điện tử nằm ở trạng thái kích thích
- Điện tử trở thành điện tử tự do khi điện tử hấp thụ hay giải thoát năng lượng quang tuyến . Điện tử sẻ đi ra khỏi nguyên tử khi điện tử hấp thụ năng lượng quang tuyến . Điện tử sẻ đi vô trong nguyên tử khi điện tử giải thoát năng lượng quang tuyến
Bán kín quỳ đạo
[sửa]Tính toán Bohr
[sửa]Bán kín Bohr
[sửa]Cho lực Coulomb bằng lực ly tâm
Bohr điều kiện để lượng tử hóa của góc độn lượng
Giải tìm v
Thế v vào r
Với Hydrogen Z=1, n=1
- được biết là bán kín Bohr Bohr radius
Tầng năng lượng lượng tử
[sửa]Với Hydrogen Z=1
n được biết là số lượng tử Principal quantum number
Vạch sáng Line spectra
[sửa]
Vạch sáng Lyman
- . Với n=2,3,4 ... 91-122nm
Vạch sáng Balmer
- . Với n=3,4,5 ... 365-656nm
Vạch sáng Paschen
- . Với n=4,5,6 ... 820-1875nm
Đơn vị đo lường nguyên tử
[sửa]Nguyên Tử đo bằng đơn vị Mô Mol . Một Mol nguyên tử của một nguyên tố là lượng nguyên tố đó có chứa NA nguyên tử của nguyên tố đó . Mol nguyên tử của một nguyên tố là lượng nguyên tố đó có chứa NA nguyên tử của nguyên tố đó . Mol phân tử của một Chất là lượng chất của NA phân tử chất đó
- nguyên tử lượng
Thí dụ
- Một mol nguyên tử kali (K) có 6,02×1023 nguyên tử K
- Một mol phan tử clo (Cl2) 6,02×1023 nguyen tử khí clo




































