Sách công thức/Sách công thức Vật lý/Công thức Nhiệt
Nhiệt độ và nhiệt
[sửa]Nhiệt độ Nhiệt Thí dụ Nhiệt độ C Nhiệt độ F Nhiệt độ K Cao Nóng Rắn 0oC Trung bình Ấm Lỏng 25oC Thấp Lạnh Khí 100oC
Chuyển đổi nhiệt độ
[sửa]Các công thức đổi nhiệt độ Đổi từ Sang Công thức Fahrenheit Celsius °C = 5/9 (F – 32) Celsius Fahrenheit °F = 9/5 C + 32 Celsius Kelvin K = C + 273,15 Kelvin Celsius °C = K - 273,15 Kelvin Fahrenheit °F= 9/5 (K – 273,15) + 32 Fahrenheit Kelvin K = 5/9 (F - 32) + 273,15
Nhiệt độ chuẩn
[sửa]Nhiệt độ Áp suất tiêu chuẩn STP -
Nhiệt độ vật chất
Rắn -
Lỏng - .
Khí -
Nhiệt độ 0 tuyệt đối
Nhiệt độ phòng
Thí nghiệm lửa và vật
[sửa]Trạng thái vật chất
[sửa]Thí nghiệm cho thấy khi vật và lửa tương tác với nhau, vật có thay đổi trạng thái từ rắn sang lỏng sang khí do có thay đổi nhiệt độ trên vật
Quá trình thay đổi trạng thái Định nghỉa Nhiệt độ thay đổi trạng thái Nhiệt độ Quá trình nóng chảy Quá trình vật chuyển đổi trạng thái từ rắn sang lỏng Nhiệt đô nóng chảy . Quá trình bốc hơi Quá trình vật chuyển đổi trạng thái từ lỏng sang khí Nhiệt đô bốc hơi Quá trình đông đặc Quá trình vật chuyển đổi trạng thái từ lỏng sang rắn Nhiệt đô đông đặc
Mọi vật tồn tại ở 4 trạng thái 1. Rắn , 2. Lỏng , 3. Khí , 4. plasma . Sự biến đổi trạng thái của vật chất được được mô tả qua Phương trình trạng thái
Bao gồm cá phương trình dưới đây
Định luật công thức Ý nghỉa Định luật Boyle (1662) Áp lực và thể tích tỉ lệ nghịch với nhau Định luật Charles (1787) Định luật Avogadro (1812) Định luật Benoît Paul Émile Clapeyron in (1834) Định luật Van der Waals (1873) khí lý tưởng (1834) where: Định luật áp lực từng phần của Dalton (1801)
Phóng xạ phân rả
[sửa]Phóng xạ vật đen
[sửa]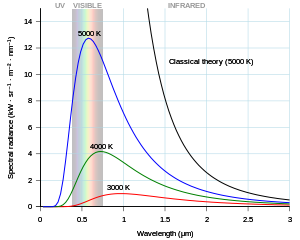
Planck biết rằng vật tối hấp thụ năng lượng nhiệt tốt nhứt . Planck thực hiện thí nghiệm trên vật tối và thấy rằng khi nhiệt độ tăng dần từ thấp đến cao
- Cường độ nhiệt tăng theo tần số thời gian
- Đỉnh sóng nhiệt ở bước sóng ngắn hơn
- Phát ra ánh sáng màu theo trình tự từ Trắng , Đỏ , Vàng , Tím , và Đen
Nhiệt độ Màu Cường độ nhiệt Bước sóng Lạnh Trắng Thấp Ngắn Ấm Vàng Trung Trung Nóng Đen Cao Dài
Phóng xạ nguyên tố
[sửa]Marie curie khám phá vật chất không bền do có tương tác với quang tuyến nhiệt như Uramium phân rả để trở thành vật chất bền tạo ra Phóng xạ alpha . Henry Beckelrel khám phá cho thấy vật chất đồng vị không bền do có tương tác với quang tuyến nhiệt như Carbon phân rả để trở thành vật chất bền tạo ra Phóng xạ beta
Phóng xạ alpha Phóng xạ beta Phóng xạ gamma
Phóng xạ nguyên tử
[sửa]Khi Điện tử âm đi ra khỏi nguyên tử điện

- Để có ,
Khi Điện tử âm đi vô trong nguyên tử điện
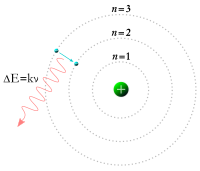
- Phóng xạ sóng diện từ
Thí nghiệm điện và vật
[sửa]Nhiệt điện
[sửa]Mọi vật dẩn điện đều có giải thoát năng lượng nhiệt vào môi trường xung quanh dưới dạng năng lượng điện thất thoát
Nhiệt điện từ
[sửa]Nhiệt điện từ Nhiệt Nhiệt quang Nhiệt điện Lối mắc  ≈≈≈
≈≈≈ ≈≈≈==
≈≈≈== ≈≈≈e
≈≈≈e
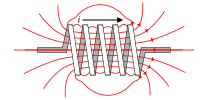
Cộng dây thẳng dẫn điện Cuộn tròn của N vòng tròn dẫn điện Cuộn tròn của N vòng tròn dẫn điện
với từ vật nằm trong các vòng quấnTần số thời gian Năng lực nhiệt
Hằng số C
Khối lượng/Lượng tử Động lượng
Bước sóng
Lượng tử hóa
Nhiệt và vật
[sửa]Nhiệt cảm
[sửa]Tỏa nhiệt sáng thấy được vào môi trường xung quanh
T Δ T W Hướng nhiệt truyền Nhiệt di chuyển từ T0 đến T1 Nhiệt di chuyển từ T1 đến T0
Nhiệt dẩn
[sửa]Tỏa nhiệt sáng chói thấy được vào môi trường xung quanh
Nhiệt phóng xạ
[sửa]Tỏa nhiệt tối không thấy được vào môi trường xung quanh
Định luật nhiệt động học
[sửa]Các định luật của nhiệt động lực học còn được gọi là các nguyên lý nhiệt động lực học.
Định luật 0
[sửa]Nguyên lý cân bằng nhiệt động, nói về cân bằng nhiệt động. Hai hệ nhiệt động đang nằm trong cân bằng nhiệt động với nhau khi chúng được cho tiếp xúc với nhau nhưng không có trao đổi năng lượng.
Nếu hai hệ có cân bằng nhiệt động với cùng một hệ thứ ba thì chúng cũng cân bằng nhiệt động với nhau
Định luật 1
[sửa]chính là định luật bảo toàn năng lượng áp dụng vào hiện tượng nhiệt, khẳng định rằng năng lượng luôn được bảo toàn. Nói cách khác, tổng năng lượng của một hệ kín là không đổi. Các sự kiện xảy ra trong hệ chẳng qua là sự chuyển năng lượng từ dạng này sang dạng khác. Như vậy năng lượng không tự sinh ra và không tự mất đi, nó luôn biến đổi trong tự nhiên. Trong toàn vũ trụ, tổng năng lượng không đổi, nó chỉ có thể chuyển từ hệ này sang hệ khác.
Độ biến thiên nội năng của hệ bằng tổng công và nhiệt lượng mà hệ nhận được ΔU = A + Q . Trong trường hợp này, chúng ta có thể quy định về dấu của A và Q để biết hệ đang nhận hay thực hiện công, nhận hay truyền nhiệt lượng. Ví dụ: Q > 0: Hệ nhận nhiệt lượng Q < 0: Hệ truyền nhiệt lượng A > 0: Hệ nhận công A < 0: Hệ thực hiện công
Định luật 2
[sửa]Nguyên lý về entropy, liên quan đến tính không thể đảo ngược của một quá trình nhiệt động lực học và đề ra khái niệm entropy. Từ đó dẫn đến định luật là không thể chuyển từ trạng thái mất trật tự sang trạng thái trật tự nếu không có sự can thiệp từ bên ngoài.
Một hệ lớn và không trao đổi năng lượng với môi trường sẽ có entropy luôn tăng hoặc không đổi theo thời gian . Entropy của một hệ kín chỉ có hai khả năng, hoặc là tăng lên, hoặc giữ nguyên
Vì entropy là mức độ hỗn loạn của hệ, định luật này nói rằng vũ trụ sẽ ngày càng "hỗn loạn" hơn. Cơ học thống kê đã chứng minh rằng định luật này là một định lý, đúng cho hệ lớn và trong thời gian dài. Đối với hệ nhỏ và thời gian ngắn, có thể có thay đổi ngẫu nhiên không tuân thủ định luật này. Nói cách khác, không như định luật 1, các định luật vật lý chi phối thế giới vi mô chỉ tuân theo định luật 2 một cách gián tiếp và có tính thống kê. Ngược lại, định luật 2 khá độc lập so với các tính chất của các định luật đó, bởi lẽ nó chỉ thể hiện khi người ta trình bày các định luật đó một cách giản lược hóa và ở quy mô nhỏ.
Định luật 3
[sửa]Nguyên lý Nernst còn được gọi là nguyên lý độ không tuyệt đối, đã từng được bàn cãi nhiều nhất, gắn liền với sự tụt xuống một trạng thái lượng tử cơ bản khi nhiệt độ của một hệ tiến đến giới hạn của độ không tuyệt đối.
Trạng thái của mọi hệ không thay đổi tại nhiệt độ không tuyệt đối (0K)



























































